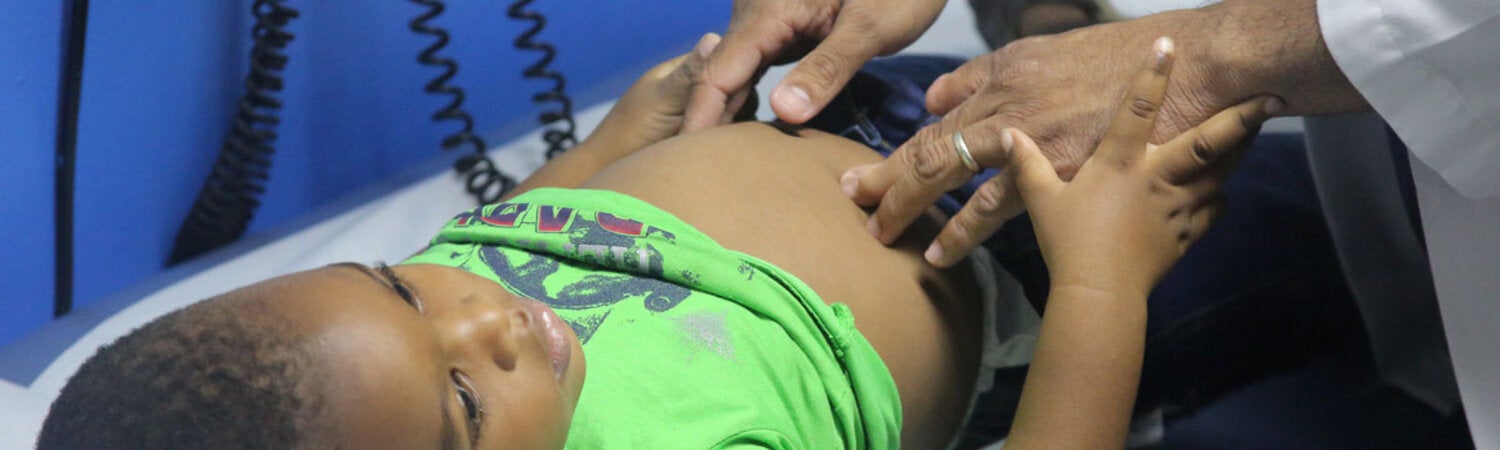
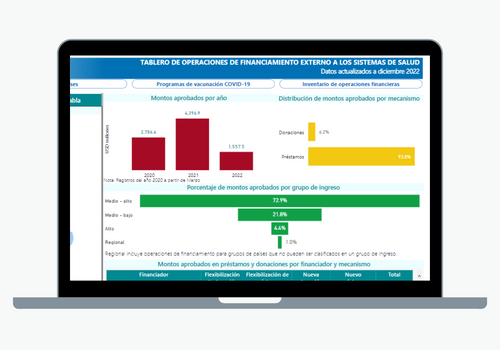
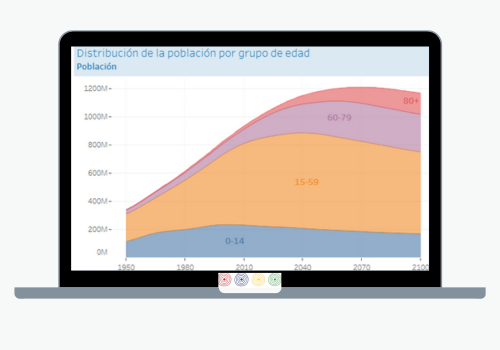
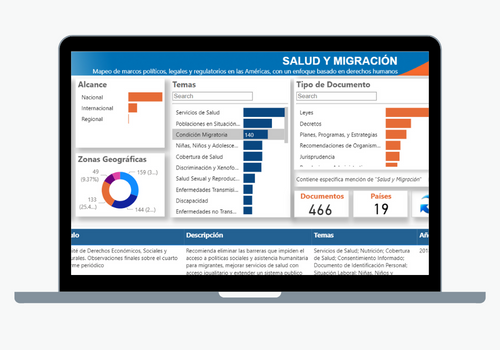
El objetivo principal del Departamento de Sistemas y Servicios de Salud es fortalecer los sistemas de salud basados en la Atención Primaria de Salud, apoyar la transformación de los sistemas nacionales de salud para mejorar la equidad y la resiliencia, fortalecer la Atención Primaria de Salud (APS) y abordar las cuestiones pertinentes relacionadas con los recursos humanos a medida que los sistemas de salud avanzan hacia la Salud Universal.
Su labor abarca las siguientes áreas: prestación de servicios integrados, fortalecimiento de la gobernanza y la rectoría en los sistemas de salud; desarrollo de mecanismos financieros eficientes y equitativos para garantizar una financiación pública adecuada del sistema de salud; recursos humanos para la salud, curso de vida saludable; el Campus Virtual de Salud Pública, y el Centro Latinoamericano de Perinatología, Mujer y Salud Reproductiva (CLAP).