Sobre nosotros
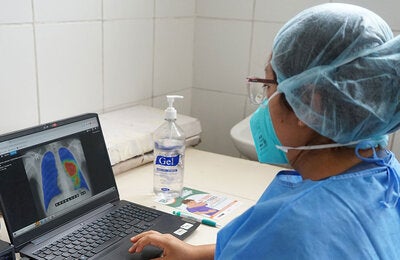
Prevención, Control y Eliminación de Enfermedades Transmisibles se responsabiliza de la promoción, coordinación e implementación de las actividades de cooperación técnica relacionadas con la vigilancia, prevención, control, eliminación y/o reducción de las enfermedades transmisibles, zoonosis, que sean técnicamente sólidas y apropiadas para el contexto político y sociocultural en el que se implementan. Pretende lograr un impacto sostenible en la salud a través de la provisión de guías normativas, la implementación de intervenciones basadas en la evidencia, el fomento de alianzas que fortalezcan la capacidad de los países, la mejora de la eficacia de la colaboración entre los países y la facilitación de políticas y procesos de toma de decisiones.
Socios estratégicos: Centros Colaboradores de la OPS/OMS