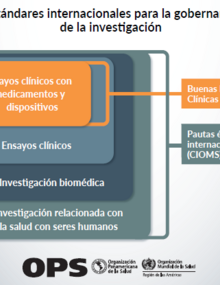
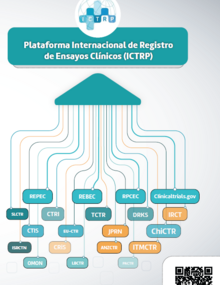
En algunos casos, las autoridades regulatorias nacionales (ARN) no existen o tienen competencias limitadas, y en otros, los requerimientos y procedimientos que establecen para la autorización y fiscalización de los ensayos clínicos no se adhieren a los estándares internacionales y se convierten en obstáculos prácticos. Estos obstáculos son más complejos aún cuando un ensayo debe cumplir con las regulaciones de diferentes ARN con distintos niveles de madurez y no existen canales de comunicación y coordinación adecuados entre la ARN y los investigadores, los comités de ética de la investigación (CEI) u otras autoridades involucradas en la realización de ensayos clínicos.
Varios CEI deben revisar el mismo ensayo clínico. A menudo son necesarias numerosas revisiones de diferentes CEI en una misma jurisdicción (es decir, en un país o estado), lo que retrasa los procesos para iniciar los ensayos sin que ello necesariamente los fortalezca desde una perspectiva ética. Además, diferentes jurisdicciones donde los ensayos se realizan requieren revisiones adicionales.
Preguntas de discusión:
- ¿Cuál es la mejor estrategia para garantizar una revisión ética rigurosa y eficiente de los ensayos clínicos en la región (es decir, dentro de jurisdicciones específicas y en los países de América Latina y el Caribe)?
- Recientemente se ha implementado en Estados Unidos una política de revisión ética única (single IRB policy), ¿se puede desarrollar una política similar para las necesidades de los países de América Latina y el Caribe, e implementarla exitosamente a la luz de las lecciones aprendidas en Estados Unidos y la experiencia previa en la centralización de los procesos de revisión ética en América Latina?
- ¿Existen otras estrategias que deberían explorarse para evitar procesos de revisión ética repetitivos, p.ej., a través de la adopción de mecanismos novedosos para la revisión ética como los utilizados en Argentina durante COVID-19 o del establecimiento de un CEI extraterritorial, al menos en ciertas jurisdicciones como el Caribe?